ACTIVITE TECHNOLOGIQUE 01 – CONTROLES QUALITES DANS LE LABORATOIRE DE BACTERIOLOGIE D'UN HÔPITAL
Publié le 06/12/2023
Extrait du document
«
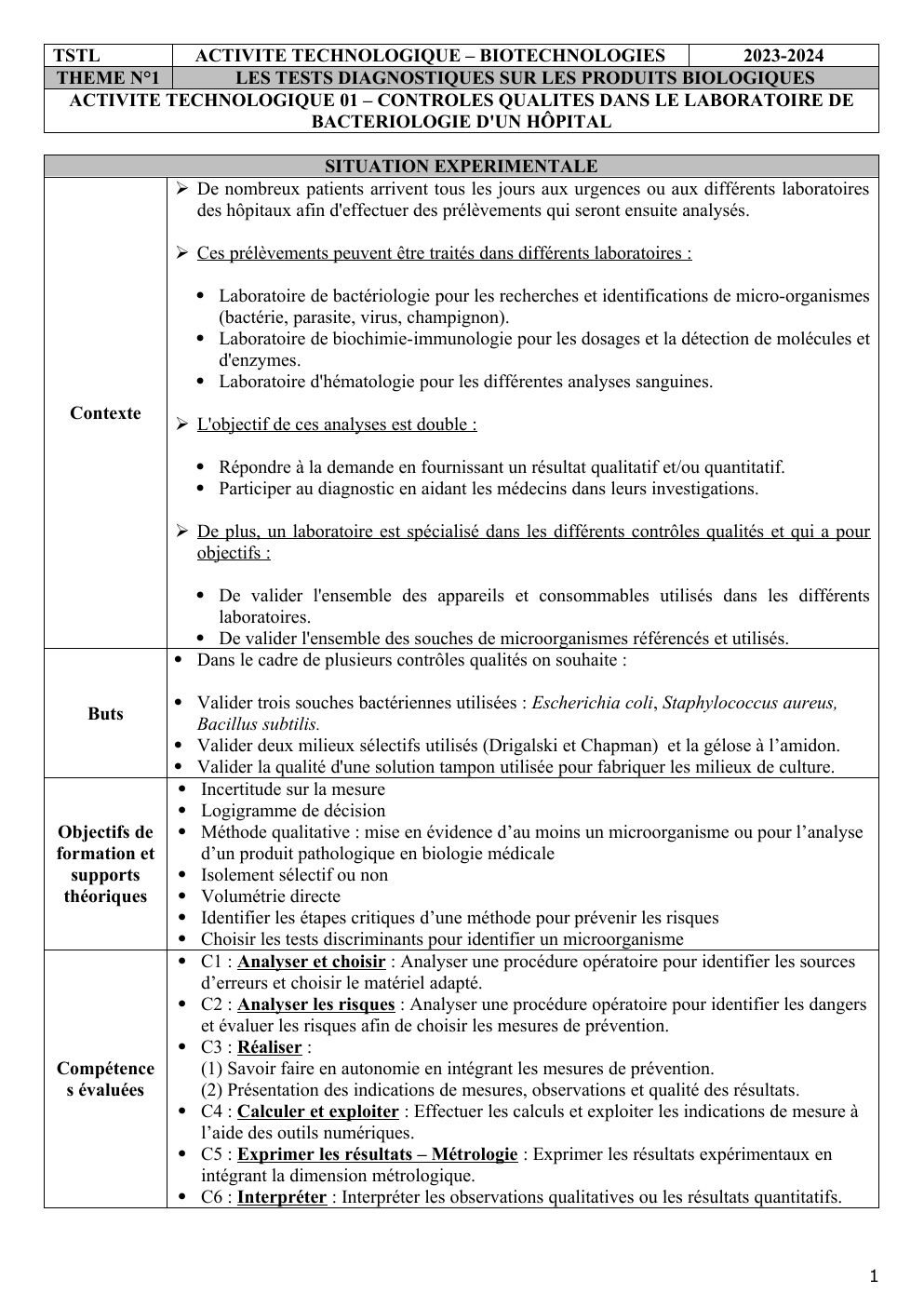
TSTL
ACTIVITE TECHNOLOGIQUE – BIOTECHNOLOGIES
2023-2024
THEME N°1
LES TESTS DIAGNOSTIQUES SUR LES PRODUITS BIOLOGIQUES
ACTIVITE TECHNOLOGIQUE 01 – CONTROLES QUALITES DANS LE LABORATOIRE DE
BACTERIOLOGIE D'UN HÔPITAL
SITUATION EXPERIMENTALE
De nombreux patients arrivent tous les jours aux urgences ou aux différents laboratoires
des hôpitaux afin d'effectuer des prélèvements qui seront ensuite analysés.
Ces prélèvements peuvent être traités dans différents laboratoires :
Laboratoire de bactériologie pour les recherches et identifications de micro-organismes
(bactérie, parasite, virus, champignon).
Laboratoire de biochimie-immunologie pour les dosages et la détection de molécules et
d'enzymes.
Laboratoire d'hématologie pour les différentes analyses sanguines.
Contexte
L'objectif de ces analyses est double :
Répondre à la demande en fournissant un résultat qualitatif et/ou quantitatif.
Participer au diagnostic en aidant les médecins dans leurs investigations.
De plus, un laboratoire est spécialisé dans les différents contrôles qualités et qui a pour
objectifs :
De valider l'ensemble des appareils et consommables utilisés dans les différents
laboratoires.
De valider l'ensemble des souches de microorganismes référencés et utilisés.
Dans le cadre de plusieurs contrôles qualités on souhaite :
Buts
Objectifs de
formation et
supports
théoriques
Compétence
s évaluées
Valider trois souches bactériennes utilisées : Escherichia coli, Staphylococcus aureus,
Bacillus subtilis.
Valider deux milieux sélectifs utilisés (Drigalski et Chapman) et la gélose à l’amidon.
Valider la qualité d'une solution tampon utilisée pour fabriquer les milieux de culture.
Incertitude sur la mesure
Logigramme de décision
Méthode qualitative : mise en évidence d’au moins un microorganisme ou pour l’analyse
d’un produit pathologique en biologie médicale
Isolement sélectif ou non
Volumétrie directe
Identifier les étapes critiques d’une méthode pour prévenir les risques
Choisir les tests discriminants pour identifier un microorganisme
C1 : Analyser et choisir : Analyser une procédure opératoire pour identifier les sources
d’erreurs et choisir le matériel adapté.
C2 : Analyser les risques : Analyser une procédure opératoire pour identifier les dangers
et évaluer les risques afin de choisir les mesures de prévention.
C3 : Réaliser :
(1) Savoir faire en autonomie en intégrant les mesures de prévention.
(2) Présentation des indications de mesures, observations et qualité des résultats.
C4 : Calculer et exploiter : Effectuer les calculs et exploiter les indications de mesure à
l’aide des outils numériques.
C5 : Exprimer les résultats – Métrologie : Exprimer les résultats expérimentaux en
intégrant la dimension métrologique.
C6 : Interpréter : Interpréter les observations qualitatives ou les résultats quantitatifs.
1
REFLEXION PRELIMINAIRE
I) Validation des souches bactériennes utilisées
Escherichia coli est un bacille Gram (-) oxydase (-), lactose (+).
Staphylococcus aureus est une coque Gram (+) catalase (+), mannitol (+).
Bacillus subtilis est un grand bacille sporulé Gram (+) catalase (+), amylase (+).
La procédure d'identification bactérienne nécessite de réaliser un état frais et une coloration de Gram (fiches
techniques 1 et 2) et un test enzymatique (fiches techniques 3 et 4).
Q1.
À partir des fiches techniques, identifier un danger éventuel (nom et pictogramme(s) associé(s)), en
précisant sa nature, la ou les voie(s) de transmission/d’exposition et une situation exposant au danger.
Proposer le (ou les) moyen(s) de prévention adapté(s).
Q2.
En utilisant les fiches techniques 3 et 4, indiquer une précaution technique à prendre concernant les deux
tests enzymatiques.
II) Validation des milieux utilisés
Les milieux à valider sont présentés dans les documents 1, 2 et 3.
Q3.
Présenter sous forme d'un tableau pour chacun des trois milieux testés :
les agents sélectifs présents.
le caractère biochimique lu.
l'observation attendue d’Escherichia coli sur le milieu sélectif.
l'observation attendue de Staphylococcus aureus sur le milieu sélectif.
l'observation attendue de Bacillus subtilis sur le milieu non sélectif.
III) Vérification du pH d'une solution tampon utilisé
La solution tampon utilisée pour réaliser les milieux de culture contient de l'acide sulfurique à 3.10-2 mol.L-1.
On souhaite étalonner cette solution pour connaître son pH exact en utilisant la fiche technique 5.
Cette solution tampon doit être au préalable diluée au 1/100 dans de l’eau distillée avant que l’on puisse
contrôler son pH.
Q4.
Proposer une procédure opératoire pour la réalisation de la dilution de cette solution permettant d’obtenir
100 mL de solution diluée : préciser les volumes, le matériel utilisé et la nature du solvant.
Q5.
A partir du principe de la fiche technique 5, écrire l'équation aux grandeurs et aux unités de cH2SO4, solution
tampon.
N’oubliez pas de tenir compte de la dilution au 1/100.
2
La réalisation pratique doit débuter par une analyse des risques de l’ensemble des manipulations.
La
mise en œuvre des mesures de prévention appropriées à chaque manipulation est évaluée.
La réalisation pratique inclura la présentation des indications de mesure et/ou des observations réalisées
sur la feuille dédiée nommée cahier de laboratoire.
REALISATION PRATIQUE
I) Validation des souches bactériennes utilisées
Les trois souches à valider sont présentées sur gélose trypticase soja et noté "E" pour Escherichia coli, "S"
pour Staphylococcus aureus et "B" pour Bacillus subtilis.
Pour chacune des trois souches :
M1.
Effectuer une description macroscopique.
M2.
Réaliser une coloration de Gram et un état frais.
Réaliser une coloration des spores avec la souche de
Bacillus subtilis.
M3.
Réaliser le test enzymatique approprié (fiches techniques 3 et 4, document 3).
II) Validation des milieux utilisés
JOUR 1
A partir des trois souches de la partie précédente :
M4.
Réaliser une strie de chacune des souches sur une gélose Drigalski, sur la gélose à l’amidon et la gélose
Chapman.
M5.
Incuber les trois milieux 24-48h à 37°C.
JOUR 2
M6.
Effectuer la lecture des différents milieux ensemencés.
III) Vérification du pH d'une solution tampon utilisé
La solution tampon à étalonner est noté "H"
M7.
Procéder au dosage de la solution "H" d’après la procédure opératoire de la fiche technique 5.
PRESENTATION ET EXPLOITATION DES RESULTATS
JOUR 1
I) Validation des souches bactériennes utilisées
Pour chacune des souches :
Q6.
Rendre compte de la lecture macroscopique de la GTS.
3
Q7.
Rendre compte de la lecture microscopique de la coloration....
»
↓↓↓ APERÇU DU DOCUMENT ↓↓↓
Liens utiles
- Rapport de laboratoire : La détermination de la chaleur molaire de dissolution
- Cours sur la liberté (terminale technologique)
- Peut-on comprendre le vivant en laboratoire ?