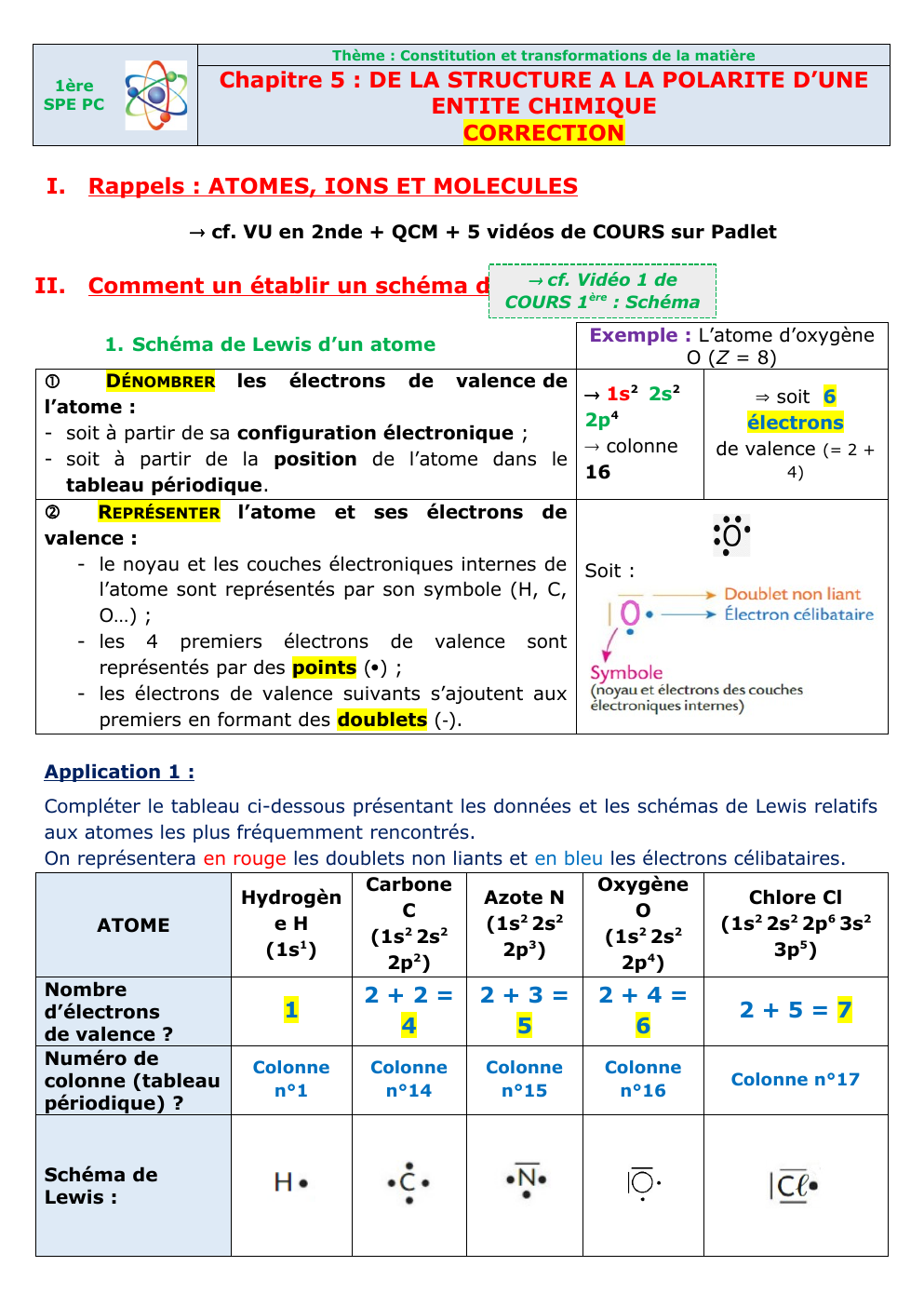
Thème : Constitution et transformations de la matière Chapitre 5 : DE LA STRUCTURE A LA POLARITE D’UNE ENTITE CHIMIQUE CORRECTION
Publié le 11/03/2023
Extrait du document
«
Thème : Constitution et transformations de la matière
Chapitre 5 : DE LA STRUCTURE A LA POLARITE D’UNE
ENTITE CHIMIQUE
CORRECTION
1ère
SPE PC
I.
Rappels : ATOMES, IONS ET MOLECULES
cf.
VU en 2nde + QCM + 5 vidéos de COURS sur Padlet
II.
cf.
Vidéo
Comment un établir un schéma de Lewis
? 1 de
ère
1.
Schéma de Lewis d’un atome
COURS 1 : Schéma
de Lewis
DÉNOMBRER les électrons de valence de
l’atome :
- soit à partir de sa configuration électronique ;
- soit à partir de la position de l’atome dans le
tableau périodique.
REPRÉSENTER l’atome et ses électrons de
valence :
- le noyau et les couches électroniques internes de
l’atome sont représentés par son symbole (H, C,
O…) ;
- les 4 premiers électrons de valence sont
représentés par des points () ;
- les électrons de valence suivants s’ajoutent aux
premiers en formant des doublets ().
Exemple : L’atome d’oxygène
O (Z = 8)
1s2 2s2
2p4
colonne
16
soit 6
électrons
de valence (= 2 +
4)
Soit :
Application 1 :
Compléter le tableau ci-dessous présentant les données et les schémas de Lewis relatifs
aux atomes les plus fréquemment rencontrés.
On représentera en rouge les doublets non liants et en bleu les électrons célibataires.
Carbone
Oxygène
Hydrogèn
Azote N
Chlore Cl
C
O
2
2
eH
(1s 2s
(1s2 2s2 2p6 3s2
ATOME
2
2
2
2
(1s 2s
(1s 2s
(1s1)
2p3)
3p5)
2
4
2p )
2p )
Nombre
2+2= 2+3= 2+4=
1
2+5=7
d’électrons
4
5
6
de valence ?
Numéro de
Colonne
Colonne
Colonne
Colonne
Colonne n°17
colonne (tableau
n°1
n°14
n°15
n°16
périodique) ?
Schéma de
Lewis :
Nombre de
0
0
doublets non
liants ?
Nombre
1
4
d’électrons
célibataires ?
2.
Schéma de Lewis d’une molécule
1
2
3
3
2
1
Le schéma de Lewis d’une molécule s’établit en assemblant les schémas de Lewis
des atomes.
cf.
Étapes , et ci-dessous.
Exemple : Le méthanal CH2O
Étape :
Schémas de Lewis des
atomes
Avec 4 électrons
célibataires,
le carbone C est l’atome
central : il forme 4
liaisons.
Étape :
Appariement des électrons
célibataires
Étape :
Schéma de Lewis final
Les électrons célibataires sont
appariés deux à deux.
Formation des doublets
liants entre les atomes (=
liaisons covalentes).
Les
doublets
d’électrons
partagés par les atomes sont
des doublets liants.
L’atome O porte 2 doublets qui
ne sont pas engagés dans des
liaisons :
ce sont doublets non liants.
Doublet
s
non
liants
Double
ts
liants
De manière générale :
Un atome forme autant de doublets liants qu’il a d’électrons célibataires.
L’atome central est celui qui possède le plus d’électrons célibataires.
Conformément aux règles de stabilité :
® l’hydrogène s’entoure de 1 doublet liant, soit 2 électrons de valence ;
® les autres atomes s’entourent de 4 doublets (liants + non liants), soit 8
électrons de valence.
Il existe des exceptions aux règles de stabilité :
Une lacune électronique indique un déficit de 2 électrons par rapport aux règles de
stabilités : dans un schéma de Lewis, elle est représentée par une case rectangulaire
vide (
).
Exemple :
L’atome de bore B (1s2 2s2 2p1) possède 3 électrons de
valence.
Dans la molécule de borane BH3, l’atome B est entouré
de 3 doublets liants, soit 6 électrons de valence au lieu
de 8 1 lacune
sur B
Application 2 : Établir les schémas de Lewis des molécules suivantes.
Chlorure
d’hydrogène
HCl
Dioxygè
ne O2
Méthane
CH4
Ammoniac
NH3
Eau
H2O
Dioxyde de
carbone CO2
3.
Schéma de Lewis d’un ion
On procède comme pour les atomes et les molécules mais en indiquant la
charge électrique des atomes :
un atome qui présente un déficit d’électrons par rapport à l’état isolé porte
une charge positive ;
un atome qui présente un excès d’électrons par rapport à l’état isolé porte
une charge négative.
a.
Cas d’un ion monoatomique (= formé à partir d’un seul atome) :
Exemple : Schéma de Lewis de l’ion chlorure ClAtome de chlore Cl
Gain de 1 électron pour
isolé
acquérir
1s2 2s2 2p6 3s2 2p5
8 électrons de valence :
7 électrons de
valence
Schéma de
Lewis :
b.
Cas d’un ion polyatomique (= formé à partir de plusieurs atomes) :
Exemple : Schéma
oxonium H3O+
de
Lewis
de
À l’état isolé :
l’atome O possède 6 électrons de
valence.
l’ion
Pourquoi une charge + sur O ?
Comparons le nombre d’électrons de
valence de l’atome au sein de l’ion par
rapport à l’état isolé...
Au sein de l’ion H3O+ : l’atome O n’apporte que 5
électrons.
déficit de 1 électron par rapport à l’état isolé
1 charge positive
Application 3 : Établir les schémas de Lewis des ions suivants.
Ions MONOATOMIQUES
Ion sodium
Na+
Donnée : Na (Z =
11)
1s2 2s2 2p6 3s1
Ion oxyde
O2-
Ion
hydrogène
H+
Ions POLYOATOMIQUES
Ion ammonium
NH4+
Ion hydroxyde
HO-....
»
↓↓↓ APERÇU DU DOCUMENT ↓↓↓
Liens utiles
- correction ryle chapitre 1
- Chapitre 4 de "Matière et Mémoire" de Bergson
- La vie est-elle une propriété physico-chimique de la matière ?
- Chapitre 11. Axe 1. Comment définir et mesurer la mobilité sociale ?
- Correction de l’explication d’un texte de Hobbes Extrait tiré de l’ouvrage Le Citoyen ou Les Fondements de la politique, 1642