TP CHIMIE : SYNTHESE DU PARACETAMOL
Publié le 05/06/2023
Extrait du document
«
TP CHIMIE : SYNTHESE DU PARACETAMOL
On s’intéresse dans ce TP à la synthèse du paracétamol, produit connu pour ses propriétés
anti-douleur et antipyrétiques.
I-
Introduction
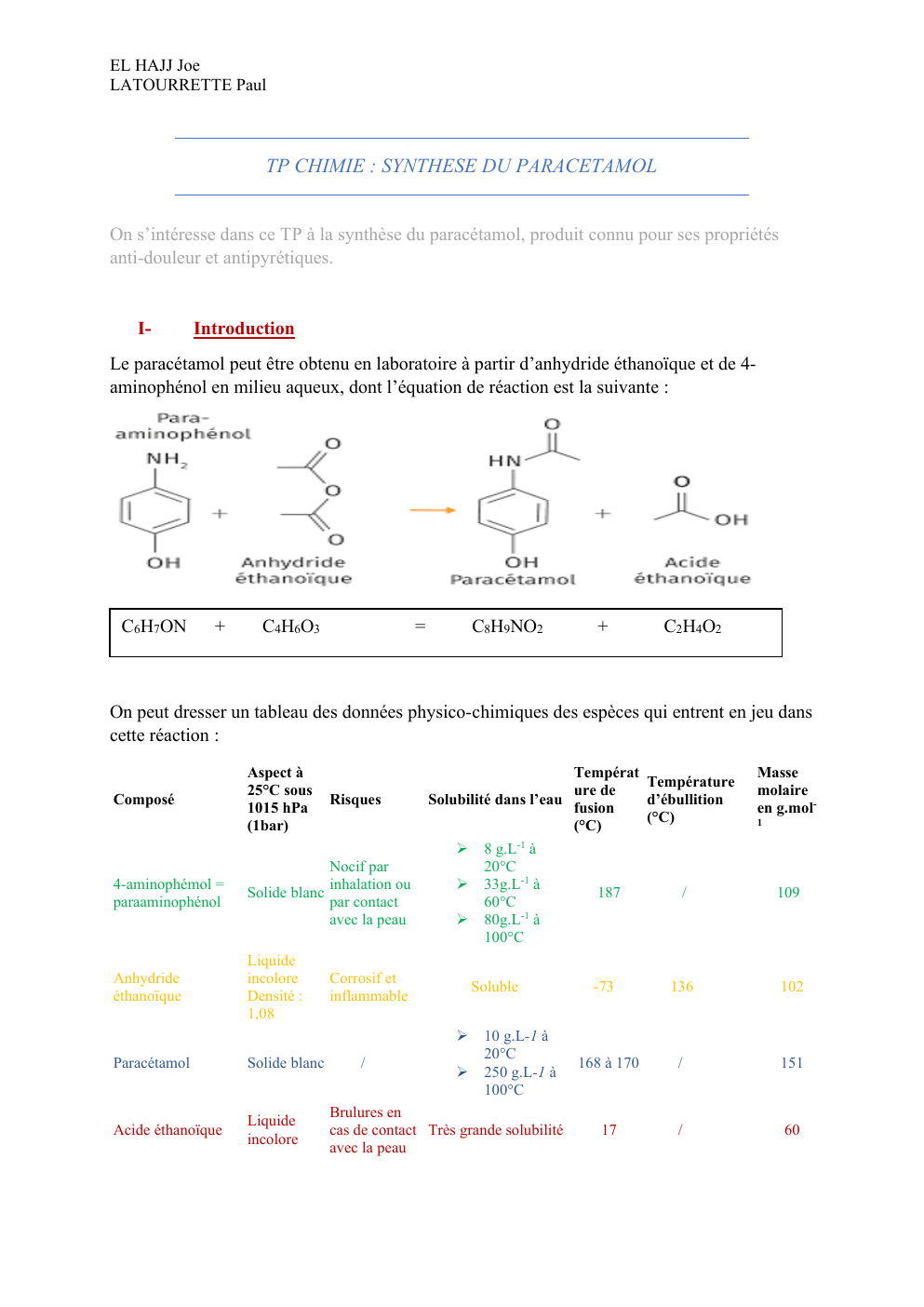
Le paracétamol peut être obtenu en laboratoire à partir d’anhydride éthanoïque et de 4aminophénol en milieu aqueux, dont l’équation de réaction est la suivante :
C6H7ON
+
C4H6O3
=
C8H9NO2
+
C2H4O2
On peut dresser un tableau des données physico-chimiques des espèces qui entrent en jeu dans
cette réaction :
Composé
Aspect à
25°C sous
1015 hPa
(1bar)
Risques
4-aminophémol =
paraaminophénol
Nocif par
inhalation ou
Solide blanc
par contact
avec la peau
Anhydride
éthanoïque
Liquide
incolore
Densité :
1,08
Températ
Température
ure de
Solubilité dans l’eau
d’ébullition
fusion
(°C)
(°C)
➢ 8 g.L-1 à
20°C
➢ 33g.L-1 à
187
/
60°C
➢ 80g.L-1 à
100°C
Corrosif et
inflammable
Soluble
➢
Paracétamol
Solide blanc
Acide éthanoïque
Liquide
incolore
/
➢
10 g.L-1 à
20°C
250 g.L-1 à
100°C
Brulures en
cas de contact Très grande solubilité
avec la peau
-73
Masse
molaire
en g.mol1
109
136
102
168 à 170
/
151
17
/
60
1.
- On sait que l’anhydride éthanoïque a une température de fusion de -73°C, et d’ébullition à
136°C.
Ici, on cherche l’état physique de l’anhydride éthanoïque à 20°C.
Or, une espèce est liquide entre sa fusion et son ébullition, et :
−73 < 20 < 136
Donc, à 20°C, l’anhydride éthanoïque est liquide.
- On sait la température du 4-aminophémol est de 187°C.
Ici, on cherche l’état physique de
l’anhydride éthanoïque à 20°C.
Or, pour une température inférieure à celle de fusion, une espèce est solide.
20 < 187
Donc, à 20°C, le 4-aminophémol est solide.
2.
La synthèse à réaliser nécessite quelques précautions pour mener à bien à celle-ci, notamment
le port obligatoire d’une blouse, de gants, de lunettes de protection et également de la
présence d’une hotte de prélèvement.
Hotte de prélèvement
II-
Etapes de la synthèse
Matériels et espèces à utiliser :
-
Chauffage
2,50 g de paraaminophénol
3,0 mL d’acide acétique pur
25 mL d’eau distillée
4 mL d’anhydride éthanoïque
Quelques grains de pierre ponce
-
Eau du lavabo
Ballon
Chauffe-ballon
Support-élévateur
Bain d’eau froide
Agitateur en verre
Filtration sous vide : filtre Büchner
Ballon de laboratoire, grains de ponce, chauffe-ballon, filtration sous vide
Protocole :
-
Introduire le paraaminophénol et l’acide acétique pur dans un ballon
Réaliser le montage du chauffage à reflux en alimentant le système en eau
-
-
Attendre la fin de la dissolution, enlever la source de chaleur, refroidir le ballon
Ajouter de manière lente l’anhydride éthanoïque pur dans le ballon
Réaliser la transformation en poursuivant le chauffage et en maintenant une agitation
Permettre la cristallisation totale en refroidissant le ballon à l’aide du bain d’eau
froide, tout en grattant le fond du ballon avec l’agitateur en verre, ce qui va permettre
d’arracher des particules de verre qui serviront de support au paracétamol qui va alors
mieux précipiter
Procéder à l’isolement du paracétamol en utilisant un filtre Büchner
1.
Groupes fonctionnels
caractéristiques du
paracétamol et de 4aminophénol
2.
Dans cette synthèse, l’eau et l’acide pur agissent comme solvant.
3.
On observe, à partir de notre tableau des données physico-chimiques des espèces qui entrent
en jeu dans cette réaction, que la solubilité du 4-aminophémol augmente avec la hausse de la
température.
La hausse de la température est un facteur cinétique qui permet de faire
augmenter la vitesse de réaction.
4.
C6H7ON
+
C4H6O3
=
C8H9NO2
+
C2H4O2
On remarque dans l’écriture de notre réaction, qu’un groupement d’atomes est transféré dans
une autre molécule pour former du paracétamol C8H9NO2.
C’est donc une réaction de
substitution.
5.
On a,
𝑛𝑖 =
𝑚
𝑀
𝑛: 𝑞𝑢𝑎𝑛𝑡𝑖𝑡é 𝑑𝑒 𝑚𝑎𝑡𝑖è𝑟𝑒 𝑒𝑛 𝑚𝑜𝑙
𝑚 ∶ 𝑚𝑎𝑠𝑠𝑒 𝑒𝑛 𝑔
𝑀 ∶ 𝑚𝑎𝑠𝑠𝑒 𝑚𝑜𝑙𝑎𝑖𝑟𝑒 𝑒𝑛 𝑔.
𝑚𝑜𝑙 −1
Pour le paraaminophénol,
𝑛𝑖 (𝐶6 𝐻7 𝑂𝑁) =
𝑚𝑖𝑛𝑡𝑟𝑜𝑑𝑢𝑖𝑡𝑒
𝑀𝐶6𝐻7 𝑂𝑁
A.N
𝑛𝑖 (𝐶6 𝐻7 𝑂𝑁) =
2,50
109
𝒏𝒊 (𝑪𝟔 𝑯𝟕 𝑶𝑵) = 𝟐, 𝟑 × 𝟏𝟎−𝟐 𝒎𝒐𝒍
Pour l’anhydride éthanoïque,
𝑛𝑖 (𝐶4 𝐻6 03 ) =
𝑚𝑖𝑛𝑡𝑟𝑜𝑑𝑢𝑖𝑡𝑒
𝑀𝐶4𝐻6 03
Or,
𝑚
𝑉
ρ=
𝑚= ρ ×V
Et,
d=
ρ
ρ𝑒𝑎𝑢
Kρ : masse volumique en m.L-1
d : densité
Donc,
𝑛𝑖 (𝐶4 𝐻6 03 ) =
ρ𝑒𝑎𝑢 × 𝑑 × 𝑉
𝑀𝐶4𝐻6 03
A.N
𝑛𝑖 (𝐶4 𝐻6 03 ) =
1,0 × 1,08 × 4,0
102
𝒏𝒊 (𝑪𝟒 𝑯𝟔 𝟎𝟑 ) = 𝟒, 𝟐 × 𝟏𝟎−𝟐 𝒎𝒐𝒍
Déterminons le réactif limitant,
-
-
Si le paraaminophénol est le réactif limitant, alors :
𝑛𝑖 (𝐶6 𝐻7 𝑂𝑁) − 𝑥𝑚𝑎𝑥 = 0
𝑛𝑖 (𝐶6 𝐻7 𝑂𝑁) = 𝑥𝑚𝑎𝑥
Donc,
𝒙𝒎𝒂𝒙 = 𝟐, 𝟑 × 𝟏𝟎−𝟐 𝒎𝒐𝒍
Si l’anhydride éthanoïque est le réactif limitant, alors :
𝑛𝑖 (𝐶4 𝐻6 03 ) − 𝑥𝑚𝑎𝑥 = 0
𝑛𝑖 (𝐶4 𝐻6 03 ) = 𝑥𝑚𝑎𝑥
Donc,
xmax = 4,2 × 10−2 mol
On garde la plus petite valeur de 𝑥𝑚𝑎𝑥 et donc, le réactif limitant est le paraaminophénol.
6.
On vient de démontrer que le réactif limitant était le paraaminophénol, et donc l’anhydride
éthanoïque est en excès, il est ainsi pas nécessaire de mesurer son volume avec précision.
7.
L’excès d’anhydride éthanoïque est éliminé à la fin de la réaction grâce à la hausse de la
température du mélange réactionnel induisant....
»
↓↓↓ APERÇU DU DOCUMENT ↓↓↓
Liens utiles
- Grand Oral PHYSIQUE-CHIMIE Problématique : Dans quelle mesure la chimie a-t-elle contribué à la résolution de l’affaire du meurtre d’O.J Simpson (malgré les obstacles juridiques et médiatiques durant le procès) ?
- grand oral physique chimie
- Physique Chimie Bac S 2015 Pondichéry Exercice I. LA VITAMINE C extrait modifié CORRECTION
- grand oral: chimie organique: Comment limiter l’impact environnemental d’une synthèse organique?
- grand oral chimie L’oxydation